2025年成考高起点每日一练《理化综合》5月1日专为备考2025年理化综合考生准备,帮助考生通过每日坚持练习,逐步提升考试成绩。
单选题
1、铁钉和碳棒用导线连接后,浸入0.01mol/L的食盐溶液中,可能发生的反应是()。
- A:碳棒上放出氯气
- B:碳棒附近产生OH-
- C:碳棒上放出氧气
- D:铁钉不发生变化
答 案:B
2、下列关于Cl2的描述,正确的是()。
- A:Cl2以液态形式存在时可称作氯水或液氯
- B:红热的铜丝在氯气中燃烧后生成蓝色的CuCl2
- C:氯气既可作氧化剂又可作还原剂
- D:Fe在Cl2中燃烧生成FeCl2
答 案:C
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、如图,一质量为m1的木块静置在光滑的水平面上,一质量为m2的子弹以速度v0水平射入木块,进入木块s距离后相对木块静止。设子弹相对木块静止前受到的阻力恒定。求从子弹开始进入到相对木块静止这段时间内
(1)子弹与木块组成的系统损失的机械能。
(2)木块移动的距离。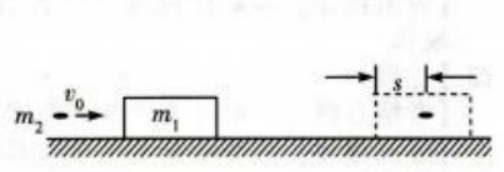
答 案:(1)根据动量守恒定律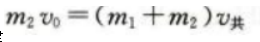 根据功能关系
根据功能关系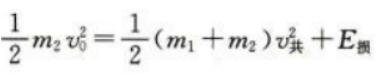
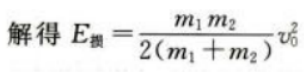 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
2、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: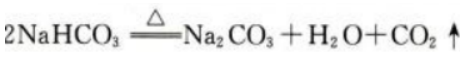 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
填空题
1、元素X、Y、Z都位于短周期,它们的原子序数按X、Y、Z的顺序依次减小。X原子的最外层与最内层电子数之比为1:1,Z原子的最外层电子数是内层电子数的2倍,Y原子的核外电子数比Z原子的多2个。化合物XY的化学键为()键,化合物ZY,的电子式为()
答 案:离子;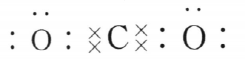
解 析:根据核外电子排布和元素周期表可推断出元素X为Mg,Y为O,Z为C,故MgO中含离子键,CO2的电子式为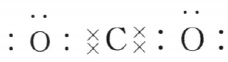
2、同温同压下与4gH2气体体积相同的O2气体为()g。
答 案:64
简答题
1、一位同学用单摆做测量重力加速度的实验,他将摆挂起后,按如下步骤进行:
(1)测摆长l:用米尺量出摆线的长度,
(2)测周期T:将摆球拉起后放开,在摆球某次通过最低点时,按下秒表开始计时,同时将此次通过最低点作为第一次,接着一直数到第60次通过最低点时,按秒表停止计时,读出这段时间算出单摆周期 (3)将所测的l和T代入
(3)将所测的l和T代入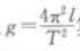 算出g,将它作为实验的最后结果写入报告中,
指出上面步骤中遗漏或错误地方,写出该步骤的编号,并加以改正.
算出g,将它作为实验的最后结果写入报告中,
指出上面步骤中遗漏或错误地方,写出该步骤的编号,并加以改正.
答 案:(1)应量出悬点到球心的距离; (2)摆球应拉至与竖直方向夹角小于5。的位置,周期应为 (3)应改变摆长再做几次实验,求出g的平均值作为实验结果。
(3)应改变摆长再做几次实验,求出g的平均值作为实验结果。
2、以 30m/s的初速度水平抛出一个小球,经过多长时间小球的速度方向与竖直方向成45°角,此时小球离开抛出点的位移为多大(g取 10 m/s2)?
答 案:当小球的速度方向与竖直方向成45°角时,小球速度与水平方向的夹角也是45°,这表明此时速度的水平分量与竖直分量相等,即 
精彩评论